Вода очищенная и для инъекций. Способы получения. Слабые механические воздействия и магнитное поле Земли. Технический регламент обезопасном хранении лекарственных средств в фармацевтических организациях и организациях здравоохранения и санитарном режиме ф
Вода - одно из самых важных веществ в природе. Без неё не обходится ни один живой организм, более того, благодаря ей они и возникли на нашей планете. В разных странах человек расходует от 30 до 5 000 кубических метров воды в год. Какую пользу из неё извлекают? Какие способы получения и применения воды существуют?
Она окружает нас повсюду
Вода - самое распространенное вещество на Земле и точно не последнее в космосе. В зависимости от состава и свойств, она бывает жесткая и мягкая, морская, солоноватая и пресная, легкая, тяжёлая и сверхтяжёлая.
Это оксид водорода - неорганическое соединение, при нормальных условиях жидкое, не имеет ни запаха, ни вкуса. При небольшой толщине слоя жидкость бесцветна, с его увеличением может приобретать голубоватый и зеленоватый оттенки.
Она способствует протеканию многих химических реакций, ускоряя их. В теле человека вода составляет около 70 %. Находясь в клетках всех животных и растений, она способствует обмену веществ, терморегуляции и другим жизненно важным функциям.
В трех агрегатных состояниях она окружает нас повсюду, участвуя в круговороте веществ в природе. В виде водяного пара она присутствует в воздухе. Из него она попадает на поверхность Земли в виде атмосферных осадков (льда, тумана, дождя, инея, снега, росы и т. д.). Она попадает в реки и океаны сверху, просачивается в них сквозь грунт. Через какое-то время испаряется с их поверхности, вновь попадая в атмосферу и замыкая круг.
Основной ресурс Земли
Все поверхностные и подземные воды нашей планеты, включая атмосферный пар, объединяются в понятие гидросфера, или водная оболочка. Её объем составляет почти 1,4 миллиона кубических километров.
Около 71 % приходится на Мировой океан - непрерывную оболочку, которая окружает всю сушу Земли. Он делится на океаны Тихий, Атлантический, Северный Ледовитый, Индийский, Южный (по некоторым классификациям) океаны, моря, заливы, проливы и т. д. Мировой океан наполняет соленая морская вода, непригодная для питья.
Вся питьевая вода (пресная) находится в пределах суши. Она составляет всего лишь 2,5-3 % от всего объема гидросферы. Пресные реки, часть озер, ручьи, ледники и горный снег, подземные воды. Они распределены неравномерно. Так, в отдельных частях планеты существуют крайне засушливые и пустынные местности, которые не увлажнялись сотни лет.
Большая часть пресных вод находится в ледниках. В них хранится около 80-90 % всех мировых запасов этого ценного ресурса. Ледники покрывают 16 миллионов квадратных километров суши, они располагаются в приполярных областях и на вершинах высоких гор.

Источник жизни
Вода появилась на Земле миллиарды лет назад, то ли высвободившись в ходе химических реакций, то ли прибыв сюда в составе комет и астероидов. С тех пор она является неотъемлемой частью нашей жизни.
Человек и животные пьют её, растения всасывают корнями (или другими органами) для поддержания сил и энергии. Огромная часть жидкости поступает в организм вместе с продуктами питания.
В целом людям необходимо 5-10 литров воды в день, а в виде жидкости - около двух. Животные и растения могут употреблять её больше. Например, бегемоты пьют около 300 литров в сутки, примерно такое же количество необходимо и эвкалипту.
Применение воды в природе не ограничивается питьем. Для ряда организмов она является местом обитания. В реках и океанах растут водоросли, живут рыбы, планктон, амфибии, членистоногие, некоторые млекопитающие и другие существа.
Способы применения воды
В нашей повседневной жизни ни один день не обходится без воды. При этом обычно используются пресные запасы, количество которых весьма ограничено. Огромные объемы этого ресурса тратятся в быту во время уборки, стирки, мытья посуды, приготовлении пищи.
Кроме того, применение воды необходимо для личной гигиены. С этой целью её используют не только дома, но и во всех рабочих учреждениях, в особенности в больницах. В медицине её также употребляют для лечебных ванн, компрессов, обтираний, добавляют в состав препаратов.
Незаменима она и промышленности. Здесь во многом пригождается её свойство растворять различные вещества, будь то другие жидкости, соли или газы. Её используют для получения азотистой, уксусной, соляной кислот, оснований, спирта, аммиак и т. д. Ежегодно с пресных озер и рек изымается более 1000 кубических километров сырья в производственных целях.
Применение воды связано с такими видами спорта, как фигурное катание, хоккей, плавание, биатлон, гребля, серфинг, водно-моторный спорт. Она необходима при тушении пожара, для ведения сельского хозяйства.

Энергетика
Ещё одна область применения воды - энергетика. На тепловых и электрических станциях вода используется для охлаждения турбин, а также для получения пара. Только для производства одного гигаватта электричества тепловые станции потребляют от 30 до 40 кубических метров воды в секунду.
Применение воды на гидроэлектростанциях основано на других принципах. Здесь электричество вырабатывается за счет скорости течения рек. Станции устанавливают в местах с естественными перепадами высот. Там, где реки не столь стремительны, перепады высот создают искусственно при помощи дамб и плотин.

В Китае, Индии, США, Франции и других странах для производства энергии используют силу приливов. Такие станции (ПЭС) строят на морских побережьях, где уровень воды изменяется несколько раз в день под действием сил притяжения Солнца и Луны.
Морские волны тоже могут давать энергию. Их удельная мощность даже превышает ветровую и приливную. Станций, генерирующих энергию таким способом, пока немного. Первая появилась в 2008 году в Португалии, она обслуживает примерно 1 500 домов. Ещё как минимум одна станция находится в Великобритании на
Сельское хозяйство
Ведение сельского хозяйства невозможно без применения воды. В основном она используется для полива, а также снабжения птиц и скота. Только на разведение десяти тысяч коров может понадобиться 600 кубометров воды. На возделывание риса в среднем уходит 2400 л, на виноград - 600 л, а на картофель - 200 литров.
Часть воды для полива полей и плантаций приходит естественным путем в виде атмосферных осадков. В некоторых странах, например, Великобритании, на них приходится основная доля водоснабжения.
Там, где климат более засушливый, на помощь приходят Они появились ещё в Месопотамии и Древнем Египте. С тех пор они, конечно, усовершенствовались, но не утратили актуальности. Орошение применяется в странах Азии, Южной Америки и Европы. В горных участках оно террасное, на равнинных участках - паводковое.

Ресурс для отдыха
Одна из самых приятных сфер применения воды человеком - сфера рекреации. Ущерб от такого использования ресурса намного меньше, чем в других областях. К тому же чаще всего люди стремятся поехать не на пресные, а именно на морские водоемы.

На морях и океанах распространен пляжно-купальный отдых. В России популярностью пользуется побережье Черного и Азовского морей. Большинство водоемов дает возможность для развития водного спорта, прогулок на лодках и катера, а также рыбалки.
Регионы с минеральными водами привлекают желающих не только отдохнуть, но и поправить здоровье. Как правило, в таких местах расположены бальнеологические курорты и санатории. насыщены различными солями и микроэлементами, например, серой, магнием, кальцием и т. д. В зависимости от состава, они могут воздействовать на различные органы в теле человека, улучшая их работу.
Ионный обмен
Используются колонки с ионообменными смолами, которые делятся на 2 группы.
Катиониты - смолы с кислой карбоксильной или сульфоновой группой, обменивают ионы водорода на ионы щелочных и щелочноземельных металлов;
Аниониты - в основном продукты полимеризации аминов с формальдегидом. Обменивают свои гидроксильные группы на анионы.
Используемые для деминерализации воды ионнообменные смолы являются прекрасным субстратом для размножения бактерий, поэтому данным методом нельзя пользоваться для получения воды для инъекций.
Принцип обратного осмоса
Основан на использовании полупроницаемых мембран. Эти мембраны удерживают до 100% взвешенных коллоидных и растворенных веществ с молекулярной массой 200 и 95% веществ с более низкой молекулярной массой (в том числе бактерии, молекулы пирогенов). Суть обратного осмоса: под давлением, превышающим осмотическое, высокоминерализованная вода диффундирует через полупроницаемую мембрану в отсек чистой воды.
К сожалению, невозможно контролировать наличие микроскопических механических дефектов в мембранах (уже имеющихся или возникающих под давлением фильтруемой воды), что ведет к попаданию микроорганизмов в чистую воду.
Дистилляция
Самый дорогой, но и самый эффективный метод получения воды любого назначения: как очищенной, так и дистиллированной. Этапы получения дистиллированной воды:
нагрев исходной воды (после ее предварительной обработки, если в этом есть необходимость) до кипения и парообразования;
поступление пара в конденсатор и конденсация;
поступление конденсата в водоприемник: хранение и использование путем подачи через систему трубопроводов или иных механизмов доставки на рабочие места.
Теоретически дистиллят, полученный с соблюдением всех технологических правил перегонки воды, не должен содержать химические примеси в количествах выше допустимых пределов, должен быть стерильным и апирогенным. На практике это не всегда получается. Причины:
неправильная регуляция скорости кипения и, как следствие, заброс капель исходной воды с паром в конденсатор;
санитарное состояние дистиллятора, водоводов, водоприемников: нарушение режима их стерилизации способствует проникновению, сохранению и колонизации микроорганизмов (особенно грамотрицательных бактерий и плесневых грибов) на внутренних поверхностях аппаратуры и труб (ГФ XI, Приказ №309)
Для предотвращения возможности размножения микроорганизмов в получаемой дистиллированной воде рекомендовано хранить ее в одном из двух температурных режимов:
5 - +10 °С (холодовой режим),
80 - +95 °С (тепловой режим)
При обоих режимах вода должна находиться в постоянном движении со скоростью 1-3 м/сек (для предупреждения колонизации микробов на стенках).
Наиболее предпочтителен тепловой режим, так как при нем прекращается размножение микроорганизмов.
Вода очищенная, используемая для приготовления растворов, не подлежащих стерилизации в конечной упаковке, должна быть стерильной. Это растворы следующего назначения: глазные капли; офтальмологические растворы для орошения операционного поля вмикрохирургии глаза; растворы для внутреннего и наружного применения для новорожденных и т. д. Если данные растворы стерилизуются в конечной упаковке, то воду предварительно не стерилизуют.
Нормативы санитарно-микробиологического состояния воды очищенной регламентируются ФС 42-2619-97: ОМЧ 100 микроорганизмов суммарно (бактерии и грибы) в 1 мл, отсутствие энтеробактерий, синегнойной палочки и золотистого стафилококка; срок хранения не более 3 суток; апирогенность.
Санитарно-эпидемиологическая служба при контроле санитарного режима аптек пользуется в настоящее время Приказом №3182-84 от 29 декабря 1984 г., согласно которому к дистиллированной воде, используемой для приготовления лекарственных средств (кроме инъекционных растворов и глазных капель), предъявляются те же требования, что и к питьевой воде (ГОСТ 2874-82): ОМЧ - до 100 сапрофитов в 1 мл, коли-титр - не менее 500 мл.
Вода для инъекций используется для приготовления инъекционных и инфузионных растворов, которые вводятся парентерально (минуя защитные кожно-слизистые барьеры, барьеры лимфатических образований). Поэтому к ней предъявляются более высокие санитарно-микробиологические требования. Согласно ФС 42-2620- 97 вода для инъекций должна соответствовать требованиям, предъявляемым к воде очищенной, и быть апирогенной. Срок хранения не более 24 часов, в асептических условиях при температурном режиме 5-10 оС (холодовой) или 85-90 оС (тепловой).
Санитарно-эпидемиологическая служба, согласно вышеупомянутому приказу, к воде для инъекций предъявляет следующие требования: ОМЧ до стерилизации - не более 15 микроорганизмов суммарно (бактерии и грибы) в 1 мл, содержание кишечной палочки и протея не допускается.
Бактериальные пирогены
Бактериальные пирогены - продукты жизнедеятельности и распада бактерий, а также погибшие микробные клетки. По химической природе бактериальные пирогены - вещества типа полисахаридов и полипептидов с молекулярной массой 8000 000, частицы которых достигают размеров от 50 нм до 1 мкм. Пирогенными свойствами обладают практически все бактерии: патогенные и сапрофитные, грамотрицательные и грамположительные, пигментные и непигментные. Но пирогенность грамотрицательных бактерий в 100 раз выше за счет липидных компонентов клеточной стенки (ЛПС и ЛПП). Например, пирогенность извлечений из Вас. subtillis для кролика проявляется при введении дозы 0,08 мкг/кг и выше; ЛПС из возбудителей брюшного тифа (S . typhi ) вызывает пирогенную реакцию у кролика в дозе 0,06 мкг/кг, а из протея (Pr . vulgaris ) - в дозе 0,012 мкг/кг. У грамположительных бактерий пирогенность обусловлена мощным слоем пептидогликана.
Практически нет ни одного органа или ткани, системы, в которых не отмечалось бы функциональных сдвигов после введения в организм бактериальных пирогенов. Наиболее резкие пирогенные реакции возникают при внутрисосудистых, спинномозговых и черепно-мозговых инъекциях.
Клиника пирогенной реакции проявляется в следующих симптомах: озноб, повышение температуры; нарушение деятельности сердечно-сосудистой системы, падение артериального давления, рвота, диарея, развитие коматозного состояния и т. д.
Свойства пирогенов;
свободно проходят через фарфоровые фильтры;
адсорбируются на асбесте при фильтрации через фильтры Зейтца;
теряют свою активность при длительном хранении (6-8 месяцев);
сухой препарат Пирогены сохраняет свою активность до 5 лет;
адсорбируются из раствора на стенках стеклянных емкостей, в которых хранятся жидкости.
Пирогенные вещества нелетучи и не перегоняются с водными парами при дистилляции воды. Загрязнение ими дистиллята может происходит за счет перебрасывания мельчайших капелек воды или переноса их сильной струей пара в холодильник.
Пирогены могут быть внесены в исходный раствор с водой или лекарственным веществом, но в основном они высвобождаются в процессе изготовления и термической стерилизации растворов, так как при этом происходит гибель и разрушение микроорганизмов, изначально находящихся в растворе. Есть определенная зависимость между количеством микробов в 1 мл до стерилизации и пирогенностью простерилизованной воды. Эта цифра колеблется в пределах 10 3 -10 4 микробных клеток в 1 мл.
Методы разрушения пирогенов и предотвращения пирогенности:
Температурное воздействие, при котором разрушаются все органические вещества (пар под давлением - 5 часов, сухожаровой шкаф при t=180 оC - 4 часа, при t=200°C - 45 минут);
фильтрация растворов для инфузий через асбестовые фильтры;
интенсивное воздействие ультразвуком;
сорбция активированным углем;
обработка ферментами ();
химический метод (использование горячего подкисленного 1% раствора перманганата калия для обработки стеклянных трубок дистилляторов, сосудов для сбора дистиллята с последующим отмыванием от раствора).
Освободить растворы от пирогенов технологически очень сложно и в условиях аптеки практически невозможно. Поэтому все усилия должны быть направлены на получение растворов, максимально свободных от сопутствующей микрофлоры.
С целью уменьшения риска образования пирогенов в результате размножения бактерий нормативными документами регламентированы сроки и условия хранения воды для инъекций до применения по назначению (ФС 42-2620-97), а также парентеральных растворов до стерилизации (не более 3 часов по Приказу № 309).
Исследование на пирогенность
Микробиологический метод (Дополнение № 5191-90 от 11 сентября 1990 г. к методическим указаниям «Микробиологический контроль в аптеках» от 29 декабря 1984 г.). Методика обнаружения пирогенобразующих микроорганизмов в дистиллированной воде, 0,9% растворе хлорида натрия и 5, 10, 25 или 40%-м растворе глюкозы до стерилизации (не позднее 1,5 часа после изготовления) основана на выявлении количества колоний грамотрицательных микроорганизмов с помощью 3% водного раствора гидроксида калия.
Суть метода: 1 мл исследуемого образца, взятого непосредственно перед стерилизацией, засевают по 0,5 мл на поверхность двух чашек с МПА и термостатируют в течение 5 суток при температуре 30-35 °С. После инкубации в термостате каждую выросшую колонию смешивают с реактивом. Если в течение 60 секунд происходит образование желеобразной массы, данная колония образована грамотрицательными микроорганизмами, следовательно, испытуемый раствор содержит пирогенобразующие микроорганизмы. Для дистиллированной воды предельно допустимое количество пирогенобразующих единиц в 1 мл - 5, общее количество микроорганизмов - 15-20; для растворов глюкозы и натрия хлорида пирогенобразующих единиц- 10, общее количество микроорганизмов - 50. Недостатки метода:-
значительная неточность, так как определяются только живые микроорганизмы, тогда как пирогенностью обладают и «обломки» бактериальной клетки;
нельзя определить количество пирогена в исследуемом препарате;
данная методика применяется только для перечисленных Растворов и только до стерилизации, что делает невозможным исследование других парентеральных препаратов.
Биологический метод (ГФ XI, т. 2, с. 183). Испытание проводят на здоровых кроликах обоего пола массой 2-3,5 кг, содержавшихся на полноценном рационе. Каждый кролик должен находиться в помещении с постоянной температурой в отдельной клетке, при уборке которых необходимо избегать возбуждения животных. Перед проведением испытаний кроликам ежедневно измеряют температуру и взвешивают. Животные не должны терять в весе и должны иметь температуру в пределах 38,5-39,5 оС, в противном случае они не используются в опыте. Накануне испытания кролики переводятся в отдельное помещение, изолированное от шума, проводится контрольное измерение температуры и взвешивание. В испытании одного препарата используются не менее трех кроликов. Испытуемый препарат отбирается в количестве 2 флаконов или ампул из каждой серии, готовится общий раствор для каждой серии и вводится в ушную вену животному. Растворители для препарата, иглы и шприцы должны быть апирогенными. После введения испытуемого вещества измеряют температуру 3 раза с промежутками в 1 ч. Суммарно повышение температуры у 3 кроликов должно быть меньше или равно 1,4оС. Превышение на 2,2 °С означает, что испытуемый препарат обладает пирогенностью. Биологический метод имеет ряд недостатков:
необходимость содержания животных и ухода за ними;
невозможность повторного использования кроликов для определения пирогенности в последующих объектах при выявлении пирогенной реакции (только спустя 3 суток, если предыдущий препарат не обладал пирогенностью);
широкий диапазон биологическ функциональных колебаний ответной реакции кроликов на одну и ту же дозу пирогена;
невозможность определения количества пирогена в исследуемом препарате;
возможность несоответствия величины пирогенных доз для кролика и человека (описаны случаи апирогенности раствора для кролика и пирогенной реакции у человека).
Более объективными являются физико-химические методы: полярография, люминесцентный метод, но они не нашли широкого применения.
ЛАЛ-тест - более чувствительный метод, основанный на процессе физико-химического взаимодействия эндотоксинов с лизатом клеток (амебоцитов) крови мечехвостов Limulus polyphemus 1 , в результате которого происходит образование геля различной плотности (ЛАЛ-реактив - Лизат Амебоцитов Лимули, ВФС 42-2960- 97). (1 - Морское животное, относящееся к типу членистоногих.)
Определение содержания бактериальных эндотоксинов (ЛАЛ-тест). Для проведения ЛАЛ-теста необходимы ЛАЛ-реактив, рабочий стандартный образец (РСО) эндотоксина, оттитрованный фирмой-производителем по Американскому национальному стандарту эндотоксина RSE (ЕС-5), и «вода для ЛАЛ-теста», которая должна быть свободна от бактериальных эндотоксинов (содержание эндотоксинов < 0,001 ЕД э/мл) и, как правило, входит в состав наборов для ЛАЛ-теста.
Посуда (пробирки, пипетки и др.), используемая для проведения ЛАЛ-теста, должна быть стерильна и свободна от бактериальных эндотоксинов (тщательно вымыта и обработана сухим жаром при 250 °С в течение 1 часа или при 180 оС в течение 3 часов).
Проведение ЛАЛ-теста и интерпретация результатов
Качественный тест. Содержание ампулы или флакона с испытуемым препаратом разводят водой для ЛАЛ-теста. Кратность разведения {К) определяют по формуле:
где А - максимально допустимое содержание эндотоксина в препарате, указанное в частной фармакопейной статье; к - чувствительность ЛАЛ-реактива, указанная фирмой-производителем на этикетке упаковки.
Определение проводят в двух параллельных пробах. Полученный раствор препарата по 0,1 мл помещают в две стеклянные пробирки диаметром 10 мм и добавляют по 0,1 мл ЛАЛ-реактива.
Одновременно ставят положительный и отрицательный контроль опыта. Для проведения положительного контроля в две пробирки помещают по 0,1 мл ЛАЛ-реактива и по 0,1 мл раствора РСО эндотоксина. Для проведения отрицательного контроля в две пробирки вносят по 0,1 мл ЛАЛ-реактива и по 0,1 мл воды для ЛАЛ-теста.
Все реакционные смеси аккуратно перемешивают и одновременно помещают на 60 мин в водяную баню или термостат с температурой 370±1°С. Следует избегать вибрации и ударов во время инкубации. По истечении указанного срока результаты регистрируют только как положительные или отрицательные. Положительная реакция характеризуется образованием плотного геля, который не разрушается при поворачивании пробирки на 180°. При отрицательной реакции такой гель не образуется.
Результаты испытания лекарственного препарата с помощью ЛАЛ-теста можно оценивать лишь в том случае, когда в обеих пробирках с отрицательным контролем реакция отрицательна, а в обеих с положительным контролем - положительна.
Препарат считают выдержавшим испытания, если реакция отрицательна в обеих параллельных пробах. Если реакция положительна хотя бы в одной из проб, испытание повторяют с помощью полуколичественного теста.
Полуколичественный тест. Испытуемый препарат проверяют в ряду последовательных двукратных разведений водой для ЛАЛ-теста. Условия проведения количественного теста такие же, как и для качественного теста. Определение проводят в двух повторностях. Отрицательный и положительный контроли ставятся для всех серий разведений. Все пробирки инкубируются одновременно.
Для расчета количества эндотоксина в испытуемом препарате отмечается наиболее высокое разведение, дающее плотный гель, хотя бы в одной повторности. Содержание бактериальных эндотоксинов (С) определяется по формуле:
С = ТХ,
где: Т - титр наиболее высокого разведения препарата, дающего плотный гель,
X - чувствительность ЛАЛ-реактива, указанная фирмой-производителем на этикетке упаковки.
Препарат считают выдержавшим испытание, если полученное при определении количественное содержание эндотоксинов в нем не превышает максимально допустимую величину, указанную в частной фармакопейной статье.
Недостатком описанного метода является то, что с его помощью определяются только липополисахариды клеточной стенки микроорганизмов, в то время как пирогенностью обладают не только они.
Санитарно-микробиологический контроль воды,
используемой для фармацевтических целей
Согласно методическим указаниям по микробиологическому контролю в аптеках (№3182-84 от 29 декабря 1984 г.), вода забирается для исследования на разных этапах ее получения, хранения, использования с соблюдением правил асептики: конец бюретки предварительно обжигают в пламени ваты, смоченной спиртом, дают стечь первой порции, затем забирают воду в стерильные флаконы, закрывая их стерильными ватными пробками. Аналогично производят отбор проб из тройников с внешним выводом и краном при значительной длине трубопровода. С момента забора воды до ее микробиологического исследования должно проходить не более 1,5 часов (увеличение микробной массы).
В последнем случае используют специальное оборудование - апирогенные аквадистилляторы (маркировка А).
Суть метода заключается в перегонке питьевой (или обессоленной) воды в аквадистилляторах различного типа и производительности.
В аквадистилляторе любой модели можно выделить 3 узла: испаритель, конденсатор и сборник. Кроме того, все дистилляторы оснащаются датчиками уровня.
Испаритель с исходной водой нагревают до температуры кипения. Пары воды поступают в конденсатор, где они скапливаются. Накопленный жидкий дистиллят поступает в сборник. Все нелетучие загрязнители, имеющиеся в исходной воде, остаются в аквадистилляторе.
По виду нагрева различают аквадистилляторы :
- газовые (ДГ, АГ),
- огневые с топкой (ДТ, АТ),
- электрические (ДЭ, АЭ).
По конструкционным особенностям различают аквадистилляторы периодического и непрерывного действия; с одно- и двухступенчатым испарителем; с водоподготовителем (ДЭВ, АЭВ и др.); с брызгоулавливающим устройством (ДЭ-25; АЭВС и др.) .
В соответствии с ГОСТ 20887-75 производительность аквадистилляторов отечественного производства 4 и 25 л/час. Апирогенные аквадистилляторы, подготавливающие воду для инъекций, могут иметь производительность 4 , 10, 25 и 60 л/час.
С точки зрения экономической целесообразности дистилляция является дорогим методом получения очищенной воды. Из 11 литров исходной питьевой воды получают 1 литр очищенной. Поэтому на сегодняшний день актуальны более перспективные и экономичные методы приготовления воды для фармацевтических целей.
2. Ионообменный способ
Ионообменные смолы - сетчатые полимеры различной структуры и степени сшивки, в которых имеются ковалентные связи с ионогенными группами. При диссоциации ионогенных групп в воде или растворе образуется ионная пара. Один ион этой пары фиксирован на полимере, а противоион подвижен в растворе и способен обмениваться на ионы одноименного заряда из раствора.
Ионный обмен происходит на ионообменных установках- конструктивно это колонки, заполненные ионообменными смолами.
Ионообменные смолы разделяются на катиониты и аниониты. Ионообменные катиониты способны обменивать свой водородный ион на катионы Мg²⁺, Ca²⁺ и другие. Ионообменные аниониты обменивают свой гидроксил-ион на анионы SO₄²⁻ , Cl⁻ и другие. Качество воды контролируется электропроводностью. Как только ионообменная смола выработает свой ресурс, электропроводность раствора возрастает.
Колоночные аппараты для ионного обмена могут быть как с раздельными, так и со смешанными слоями катионов и анионов.
Аппараты с раздельными слоями представляют собой две последовательно расположенные колонки, одна из которых заполнена катионитами, а вторая - анионитами. Аппараты со смешанными слоями представляют собой одну колонку, наполненную смесью ионообменных смол.
Исходная вода подается через колонки снизу вверх, просачивается сначала через слой катионита, затем анионита. Частицы ионообменных смол, попавшие в воду, отфильтровываются.
По форме ионообменные смолы могут быть в виде гранул, волокон, губчатых образований, жгутов или лент. В процессе использования ионообменные смолы перемещаются в сорбционную ванну, в промывочную ванну, в бак регенерации и на отмывку.
Ионообменная технология является классическим и достаточно экономичным методом обессоливания воды. Один килограмм смолы способен очистить не менее 1000 литров воды.
Недостатки метода ионного обмена:
- многие ионообменные смолы гидрофобны, что затрудняет процессы сорбции и десорбции;
- гранулированные ионообменные смолы в процессе использования в колонках слеживаются и требуют разрыхления, а от механического воздействия разрушается их структура;
- периодическая регенерация ионообменных смол - раствором хлористоводородной кислоты (для катионитов) или раствором гидроксида натрия (для анионитов), с последующей промывкой смол;
- длительно используемые ионообменные смолы могут стать питательным субстратом для размножения микроорганизмов, поэтому им требуется периодическая дезинфекция.
3. Метод обратного осмоса
Мембранные технологии очистки воды в последние годы приобретают все более широкое применение.
Явление осмоса - это переход через полупроницаемую мембрану растворителя из раствора с низкой концентрацией примесей в раствор с более высокой концентрацией. Растворитель словно бы стремится уравнять концентрации солей в обоих растворах.
Обратный осмос идет в направлении, противоположном прямому осмосу. Под действием повышенного давления растворитель переходит через полупроницаемую мембрану из раствора с солями в ту область, где находится чистый растворитель. Движущей силой обратного осмоса является разность давлений.
Метод обратного осмоса первоначально использовался для опреснения соленой морской воды. Как оказалось впоследствии, этим методом можно получать воду высокой степени очистки - обессоленную, очищенную от механических примесей и микробов.
Состав стандартной установки обратного осмоса:
- насос высокого давления;
- один или несколько пермиаторов;
- блок регулирования рабочего режима.
Центральная часть любой обратноосмотической установки – мембрана обратного осмоса. Как правило, мембрана представляет собой спирально свернутые слои из водоподающего слоя, полупроницаемой мембраны и водосборного слоя. Вода под давлением подается с торца цилиндрически свернутой мембраны. Очищенная вода (пермеат) просачивается через полимерную пленку, достигает водосборного слоя, откуда подается в центральную водосборную трубку. Концентрат после очистки скапливается на другой стороне мембраны и отводится в дренаж .
Материалом для обратноосмотической мембраны могут служить эфиры целлюлозы - ацетаты или полиэфиры - найлон.
Мембрана с диаметром пор 0,01 мкм полностью освобождает воду от растворимых солей, органических веществ, коллоидов и микробов.
Плюсы метода получения воды очищенной методом обратного осмоса:
- относительная простота метода;
- производительность метода не зависит от начального солесодержания исходной воды;
- широкий ассортимент полупроницаемых мембран для получения воды заданного качества;
- экономичность метода: из 10 литров исходной воды получают 7,5 литров воды очищенной;
- энергоэффективность: затраты энергии идут только на работу насоса, что в 10-16 раз меньше, чем при очистке воды дистилляцией.
Недостатки метода обратного осмоса:
- выбор обратноосмотической мембаны на основе характеристик исходной воды (солесодержания, pH, концентрации Cl);
- закупорка пор мембраны в процессе водоподготовки;
- необходимость периодического включения циклов обратной фильтрации для очистки пор.
4. Электродиализный метод
При этом методе растворимые соли удаляются из воды под действием электрического поля и с помощью частично проницаемых мембран.
Селективные ионообменные мембраны подразделяются на катиониты и аниониты. Катиониты проницаемы для катионов и имеют отрицательный заряд. Аниониты проницаемы для анионов, их заряд - положительный.
Очищаемая вода помещается в ёмкость, разделенную на три части селективными мембранами. Под действием постоянного электрического тока ионы из раствора начинают притягиваться к мембране, имеющей противоположный заряд.
Ионообменные селективные мембраны не сорбируют ионы, а селективно пропускают их сквозь себя. Извлеченные из воды ионы концентрируются в соседних камерах, а в камере обессоливания остается очищенная вода. Остаточное содержание солей при этом методе водоподготовки составляет 5-20 мг/л.
Список источников
- Вода очищенная и для инъекций. Способы получения. Реферат. Самарский государственный университет. Кафедра фармацевтических технологий, 2010-2011 уч. г.
- Вода для инъекций. Методы получения. Требования GMP к получению и хранению воды для инъекций. ГОУ ВПО Санкт-Петербургская государственная химико-фармацевтическая академия. С-Пб, 2011.
Из оксидов водорода самым распространенным на Земле является вода. Эмпирическая формула – Н2О. Молекулярная масса – 18. Строение молекулы воды (структурная формула):
Молекулы воды имеют треугольную формулу: атомы водорода образуют с атомом кислорода угол, равный 104,3 %. Вблизи атома кислорода образуется отрицательно заряженное поле, т. к. наибольшая электронная плотность сосредотачивается на атоме кислорода, а вблизи атомов водорода образуется положительно заряженное поле – молекула воды – диполь. Вследствие полярности молекулы воды ассоциируют, образуя водородные связи. Последние обуславливают все физические свойства воды.
Физические свойства: вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства: вода незначительно диссоциирует:
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:
Взаимодействует со многими основными оксидами, металлами:
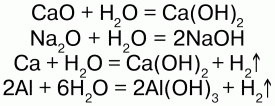
С кислотными оксидами:
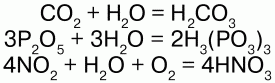
Получение: вода образуется при горении водорода в кислороде: 2Н2 + О2 = 2Н2О
Эта реакция протекает мгновенно при 700 °C. Смесь двух объемов водорода и одного объема кислорода называется гремучей смесью . Методом перегонки получают чистую воду – дистиллированную воду.
Нахождение в природе: вода составляет 2/3 поверхности Земли. Природная вода не бывает чистой, т. к. в ней растворено огромное количество солей. Вода входит в состав многих кристаллогидратов: Nа2СО3 ? 10Н2О ; CuSO4 ? 5Н2О ; MgSO4? 7Н2О . Тяжелая вода D2О отличается от обычной, образованной водородом – протием – наличием в ней второго изотопа водорода – D (дейтерия), Аr которого – 2, следовательно, молекулярная масса тяжелой воды – 20. Плотность D2О = 1,1050 г/см3; температура кипения – 101,4 °C, замерзания – 3,8 °C. Химически менее активна. Применяется в качестве замедлителя нейтронов в ядерных реакторах. Она непригодна для жизненных процессов, т. к. изменяет скорость биохимических реакций. В обычной воде частично содержится тяжелая вода.
Вся наша жизнь в буквальном смысле построена на работе различных химических веществ. Мы дышим воздухом, который содержит в себе множество различных газов. На выходе получается углекислый газ, который затем перерабатывается растениями. Мы пьем воду или молоко, которое представляет собой смесь воды с другими компонентами (жиром, минеральными солями, белком и так далее).
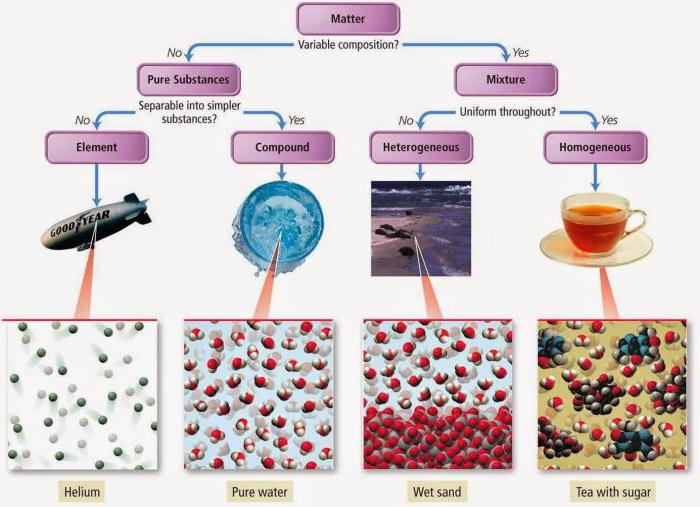
Банальное яблоко - это целый комплекс сложных химических веществ, которые взаимодействуют друг с другом и нашим организмом. Как только что-то попадает в наш желудок, вещества, входящие в продукт, поглощенный нами, начинают взаимодействие с желудочным соком. Абсолютно каждый объект: человек, овощ, животное - это набор частиц и веществ. Последние делятся на два разных типа: чистые вещества и смеси. В данном материале разберемся, какие вещества чистые, а какие из них относятся к категории смесей. Рассмотрим А также взглянем на типичные примеры чистых веществ.
Чистые вещества
Итак, в химии чистые вещества - это те вещества, что всегда состоят только из одного-единственного вида частиц. И это первое важное свойство. Чистым веществом является вода, например, которая состоит исключительно из молекул воды (то есть своих собственных). Также всегда имеет постоянный состав. Таким образом, каждая молекула воды состоит из двух атомов водорода и из одного атома кислорода.
Свойства чистых веществ, в отличие от смесей имеют постоянный характер и изменяются при появлении примесей. Только дистиллированная вода имеет температуру кипения, а морская кипит при более высокой температуре. При этом стоит учитывать, что любое чистое вещество не является абсолютно чистым, так как даже чистый алюминий имеет примесь в составе, хоть она и имеет долю в 0.001 %. Возникает вопрос, как выяснить массу чистого вещества? Формула для вычисления выглядит следующим образом - m (масса) чистого вещества = W (концентрация) чистого вещества * смесь / 100 %.
Также существует такой тип чистых веществ, как особо чистые вещества (ультрачистые, высокочистые). Такие вещества используются в производстве полупроводников в различных измерительных и вычислительных устройствах, атомной энергетике и во многих других профессиональных областях.

Примеры чистых веществ
Мы уже выяснили, что чистым веществом является то, что содержит в себе элементы одного вида. Хорошим примером чистого вещества может послужить снег. По сути это та же вода, но в отличие от той воды, с которой мы сталкиваемся ежедневно, эта вода гораздо чище и не содержит примесей. Алмаз тоже является чистым веществом, поскольку он содержит в себе только углерод без примесей. Это же относится и к горному хрусталю. На ежедневной основе мы сталкиваемся с еще одним примером чистого вещества - рафинированным сахаром, который содержит в себе одну лишь сахарозу.
Смеси
Мы уже рассмотрели чистые вещества и примеры чистых веществ, теперь перейдем к другой категории веществ - смесям. Смесь - это когда несколько веществ смешиваются друг с другом. Мы сталкиваемся со смесями на постоянной основе даже в быту. Тот же чай или мыльный раствор представляют собой смеси, которые мы применяем ежедневно. Смеси могут быть созданы человеком, а могут быть природными. Они находятся в твердом, жидком и газообразном состоянии. Как уже было сказано выше, тот же чай является смесью воды, сахара и чая. Это пример смеси, созданной человеком. Молоко является природной смесью, так как оно появляется без участия человека в процессе выработки и содержит в себе множество разных компонентов.

Смеси созданные человеком почти всегда долговечны, а природные под воздействием тепла начинают распадаться на отдельные частицы (молоко, к примеру, прокисает через несколько дней). Смеси также делятся на гетерогенные и гомогенные. Гетерогенные смеси являются неоднородными, а их компоненты видны невооруженным взглядом и под микроскопом. Такие смеси именуют взвесями, которые в свою очередь делят на суспензии (вещество в твердом состоянии и вещество в жидком состоянии) и эмульсии (два вещества в жидком состоянии). Гомогенные а их отдельные компоненты невозможно рассмотреть. Их также именуют растворами (могут быть веществами в газообразном, жидком или твердом состоянии).
Характеристики смеси и чистых веществ
Для удобства восприятия информация представлена в виде таблицы.
Сравнительный признак | Чистые вещества | Смеси |
Состав веществ | Сохраняют постоянный состав | Имеют непостоянный состав |
Виды веществ | Включают в себя различные вещества |
|
Физические свойства | Сохраняют постоянные физические свойства | Имеют непостоянные физические свойства |
Изменение энергии вещества | Изменяется при образовании энергии | Не изменяется |
Способы получения чистых веществ
В природе многие вещества существуют в виде смесей. Они применяются в фармакологии, промышленном производстве.
Для получения чистых веществ применяются различные методы разделения. Гетерогенные смеси делят с помощью отстаивания и фильтрования. Гомогенные смеси делят с помощью выпаривания и дистилляции. Рассмотрим каждый способ отдельно.
Отстаивание
Этот метод используется для разделения суспензий, таких как смесь речного песка с водой. Главным принципом, на котором основывается процесс отстаивания, является разница в плотностях тех веществ, которые будут разделены. Например, одно тяжелое вещество и вода. Какие чистые вещества тяжелее воды? Это песок, например, который в силу своей массы начнет оседать на дно. Таким же образом разделяют различные эмульсии. Например, от воды можно отделить растительное масло или нефть. Эти вещества в процессе разделения образуют небольшую пленку на поверхности воды. В лабораторных условиях этот же процесс проводят с использованием Этот способ разделения смесей работает и в природе (без участия человека). Например, осаждение сажи из дыма и отстаивание сливок в молоке.
Фильтрование
Этот метод подходит для получения чистых веществ из гетерогенных смесей, например, из смеси воды с поваренной солью. Итак, каким образом работает фильтрация в процессе разделения частиц смеси? Суть заключается в том, что у веществ различные уровни растворимости и размеры частиц.
Фильтр конструируется таким образом, чтобы через него могли пройти только частицы с той же растворимостью или тем же размером, что он может пропустить. Более крупные и другие неподходящие частицы не смогут пройти через фильтр и будут отсеяны. Роль фильтров могут играть не только специализированные устройства и растворы в пределах лаборатории, но и знакомые всем вещи, такие как вата, уголь, обожженная глина, спрессованное стекло и другие пористые объекты. Фильтры используются в реальной жизни гораздо чаще, чем может показаться.
По такому принципу работает всем нам знакомый пылесос, который отделяет крупные частицы мусора и ловко всасывает мелкие, неспособные повредить механизм. Когда вы болеете, то надеваете марлевую повязку, которая может отсеять бактерии. Рабочие, чья профессия связана с распространением опасных газов и пыли, носят защищающие их от отравления.
Воздействие магнита и воды
Таким способом можно разделить смесь порошка железа и серы. Принцип разделения основан на воздействии магнита на железо. Частицы железа притягиваются к магниту, в то время как сера останется на месте. Этот же метод можно использовать для отделения других металлических деталей из общей массы разных материалов.
Если порошок серы, смешанный с порошком железа высыпать в воду, то несмачиваемые частицы серы всплывут на поверхность воды, в то время как тяжелое железо сразу же ляжет на дно.
Выпаривание и кристаллизация
Этот способ работает с гомогенными смесями, такими как раствор соли в воде. Это работает в естественных природных процессах и лабораторных условиях. Например, некоторые озера при нагревание испаряют воду, а на ее месте остается поваренная соль. С точки зрения химии, этот процесс основывается на том, что разница между температурой кипения двух веществ, не позволяет им испариться единовременно. Уничтоженная вода обратится в пар, а оставшаяся соль останется в своем обычном состоянии.
Если вещество, которое нужно извлечь (сахар, например) плавится при нагревании, то воду не испаряют полностью. Смесь сначала прогревают, а затем получившуюся модифицированную смесь настаивают, чтобы частицы сахара осели на дне. Иногда стоит более сложная задача - отделение вещества с более высокой температурой кипения. Например, отделение воды от соли. В таком случае, испаренное вещество необходимо собрать, охладить и сконденсировать. Этот метод разделения гомогенных смесей называют дистилляцией (или просто перегонкой). Существуют специальные устройства, которые дистиллируют воду. Такая вода (дистиллированная) активно используется в фармакологии или в автомобильных системах охлаждения. Естественно, этим же методом люди перегоняют спирт.

Хроматография
Последний метод отделения - хроматография. Он основан на том, что некоторые вещества имеют свойство поглощать другие компоненты веществ. Это работает следующим образом. Если вы возьмете кусочек бумаги или ткани, на которой что-то написано чернилами и погрузите ее часть в воду, то заметите следующее: вода начнет впитываться бумагой или тканью и будет ползти вверх, а вот будет немного отставать. Используя данную методику ученый М. С. Цвет смог отделить хлорофилл (вещество, дающее зеленый окрас растениям) от зеленых частей растения.














